2019年10月10日,js345线路检测高维强、李力课题组在Nature Communications在线发表了研究成果BRG1 Attenuates Colonic Inflammation and Tumorigenesis through Autophagy-dependent Oxidative Stress Sequestration,该工作发现了BRG1在结肠炎症和肿瘤发生发展中的重要作用,并阐明了其在维持肠道稳态中的作用机制。

持续的组织炎症会导致组织修复障碍和肿瘤发生,因此,炎症性肠病(Inflammatory Bowel Disease, IBD)患者,会有极大的概率发展成为结直肠癌(Colorectal Cancer, CRC)。IBD是由肠道粘膜屏障,免疫系统和环境因素之间一系列复杂的相互作用产生。其中,肠道屏障完整性对于防止微生物入侵和慢性炎症的发展至关重要。 因此,维持肠上皮细胞(Intestinal Epithelial Cells, IEC)稳态的缺陷会引发慢性炎症,影响组织修复,进而会导致CRC的发生。
BRG1(Brahma-related gene 1; SMARCA4),是SWI / SNF染色质重塑复合物的一种ATP酶亚基。BRG1可以调控多种疾病的发生发展,它最早被认为是一个抑癌基因,在肺癌、卵巢癌以及淋巴瘤中有较高的突变率。但后续有报道称,BRG1在神经细胞瘤、急性白血病的发生过程中对肿瘤的发生起到促进作用。这说明BRG1在肿瘤中的作用取决于细胞和遗传环境的不同。已有二代测序结果发现具有高发性CRC的结肠炎患者中同样携带一定比例的BRG1突变,然而其在IBD以及CRC中的功能和机制尚未明确。
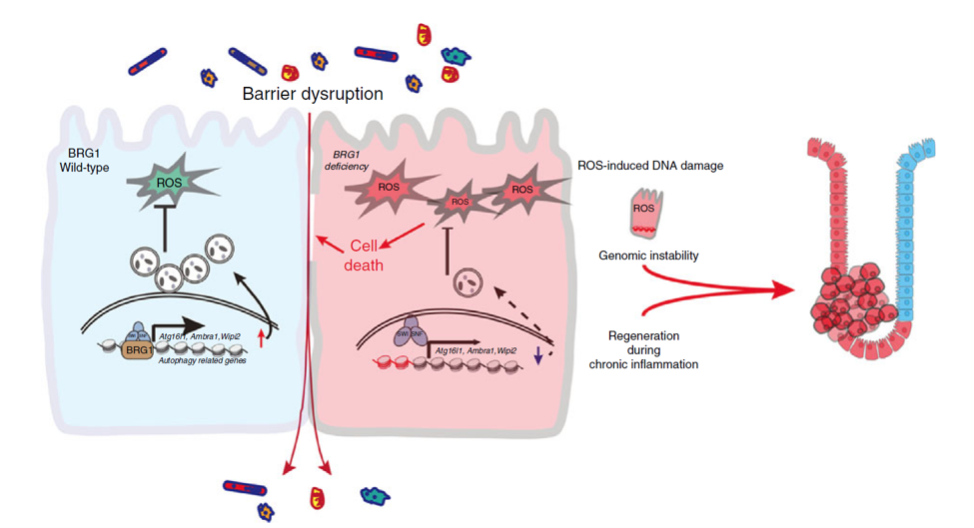
该研究利用多种转基因小鼠模型,发现BRG1缺失会促使小鼠产生自发性结肠炎,并且表现出对诱变剂DSS (Dextran sodium sulfate)诱导的肿瘤发生易感性增加。相反,BRG1过表达又可以保护小鼠免受DSS诱导的肠上皮损伤和随后的肿瘤发生。通过ChIP-seq、RNA-seq 等技术,研究者发现BRG1主要是通过直接调控Atg16l1, Ambra1, Atg7 和 Wipi2等自噬相关基因的转录来影响肠道稳态。BRG1缺失引起的自噬缺陷导致过量的活性氧(Reactive Oxygen Species, ROS)聚集,从而导致IEC凋亡和肠道屏障完整性受损,进而引起肠道炎症和肿瘤的发生。该研究结果表明BRG1可能是与IBD发病相关的自噬检查点,可能成为疾病干预的潜在治疗靶点,为IBD与CRC的治疗提供了新思路。
js345线路检测博士研究生刘敏和中国科学院上海生命科学研究院营养与健康研究所博士研究生孙同玉为该论文的共同第一作者。js345线路检测高维强教授,李力副研究员为该论文的共同通讯作者。该项研究得到了来自科技部国家重点研发计划、国家自然科学基金委、上海市科委及王宽诚基金会等资助。该研究也得到了中国科学院上海生命科学研究院营养与健康研究所秦骏研究员的大力支持。
