纳米材料联合免疫疗法在肿瘤原发瘤及其转移灶治疗方面具有巨大优势。通过纳米材料靶向,调节并加强免疫系统级联反应中的关键步骤,如抗原释放及呈递、免疫细胞介导的杀伤等,来加强肿瘤免疫循环,最大程度地激活机体免疫系统。同时通过纳米材料对肿瘤微环境的调节,克服肿瘤免疫逃逸,从而增加肿瘤的治疗效果。然而纳米材料的生物安全性、肿瘤的靶向性及基于纳米材料肿瘤的免疫原性长期激发及免疫逃逸等重要问题的解决,仍然存在巨大的挑战。基于此,js345线路检测张春富课题组在纳米调节肿瘤免疫方面开展了一系列工作。
课题组首先基于具有独特生物和光学特性的碳纳米角(single-walled carbon nanohorns,SWNHs)载体,构建了负载临床一线药物阿霉素和顺铂的肿瘤诊疗体系。研究发现该体系能同时靶向三阴性乳腺癌原发瘤及其肺部转移灶,在多模态影像(光声、荧光、核磁)引导下,实现了双化疗-热疗协同治疗。该创新性疗法克服原位瘤化疗耐药、热疗肿瘤复发、实现原位瘤治愈的同时,也成功抑制了肺转移灶[1](Theranostics 2018, 8, 1966)。

在此基础上,课题组深入研究了SWNHs介导的精准光免疫治疗晚期三阴性乳腺癌转移的治疗效果[2](Advanced Science2020,2001088)。研究发现原位瘤顺序光动力治疗(PDT)和光热治疗(PTT)可引发不同类型免疫原性蛋白释放,而作为免疫佐剂的SWNHs诊疗系统可捕获免疫原性物质,并长期、持续地从原位瘤迁移到肿瘤引流淋巴结,从而引起T细胞持久激活,并有效地浸润到原发肿瘤实质和远端转移灶。这种局部精准治疗诱发的系统性抗肿瘤免疫反应,打破了临床批准的免疫疗法(肿瘤疫苗、CAR-T和免疫检查点阻断)的局限性和免疫耐受性,增强了肿瘤免疫原性、抗原呈递和T淋巴细胞浸润,从而实现原发肿瘤和远处转移灶同时抑制,而且产生的免疫记忆效应阻止了肿瘤的复发和再次入侵。
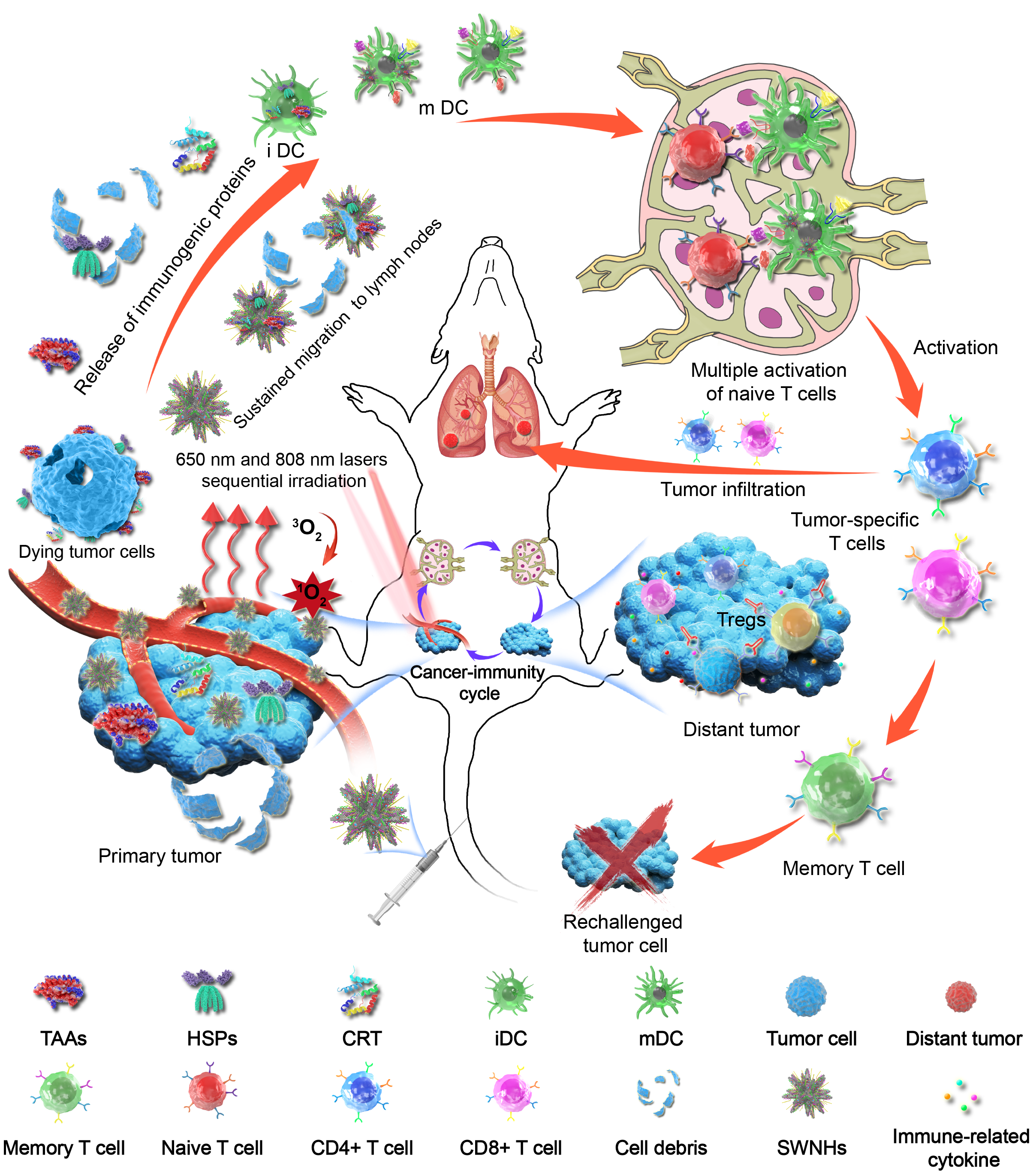
为了进一步增强光免疫治疗疗效,同时减少肝脾部对纳米载体的摄取,联合js345线路检测电子信息与电子工程学院崔大祥教授课题组,探索通过诱导多能干细胞(induced pluripotent stem cells,iPS cells)递送光动力治疗纳米系统,创造性地探讨iPS干细胞增强光免疫治疗中作用[3](Nano-Micro Letters 2020, 12)。iPS联合光动力治疗,在改变肿瘤微环境乏氧的状态下,不仅在原位引起强烈的先天性免疫,而且由于光动力治疗产生的iPS碎片提供了肿瘤共源性抗原(tumor-shared antigens),增加了DC细胞的递呈,从而激发强烈的适应性免疫。该纳米-免疫系统在降低调节性T细胞(Treg)的前提下,同样很好的抑制了原发瘤及转移灶的生长。
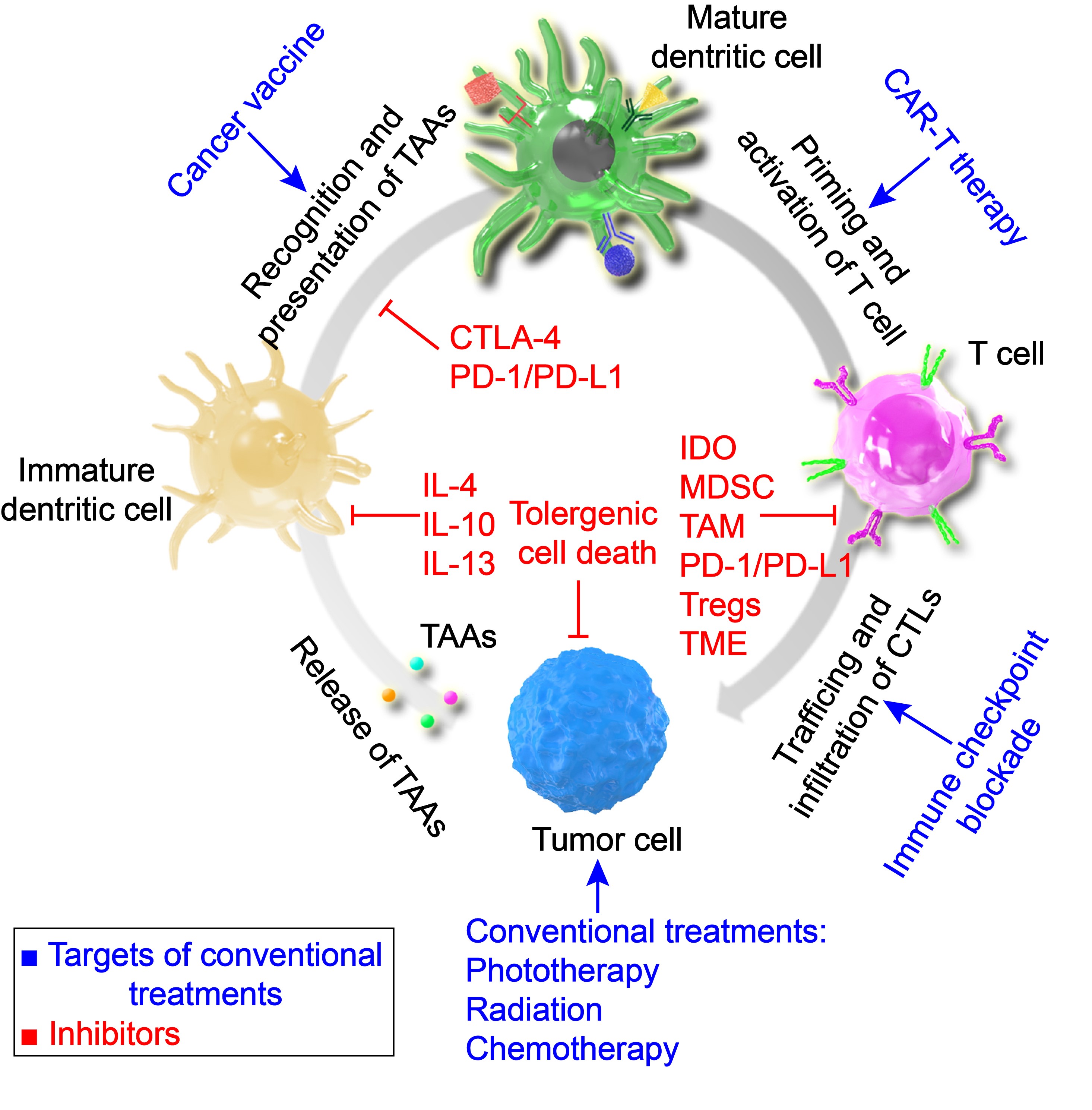
基于以上研究,受WIREs Nanomedicine & Nanobiotechnology杂志邀请,团队撰稿系统综述了纳米材料在肿瘤免疫治疗中研究进展[4](Wiley Interdiscip Rev Nanomed Nanobiotechnol 2020, 12, e1612),集中讨论了纳米材料对天然免疫反应和获得性免疫反应的有效激活和长期刺激,以及对肿瘤微环境特别是肿瘤免疫抑制微环境的调节或重塑。并且阐述了纳米材料在肿瘤免疫循环中的靶点和挑战,总结了将“冷”肿瘤转化为“热”的肿瘤免疫微环境的几种主要策略。最后,展望了纳米联合免疫治疗策略在肿瘤靶向、肿瘤免疫环境正常化和巨噬细胞修饰等方面的应用前景。
参考文献:
[1] J. Yang, H. Su, W. Sun, J. Cai, S. Liu, Y. Chai, C. Zhang, Theranostics 2018, 8, 1966.
[2] J. Yang, M. Hou, W. Sun, Q. Wu, J. Xu, L. Xiong, Y. Chai, Y. Liu, M. Yu, H. Wang, Z. P. Xu, X. Liang, C. Zhang,Advanced Science 2020, 2001088.
[3] Y. Liu, J. Yang, B. Liu, W. Cao, J. Zhang, Y. Yang, L. Ma, J. M. de la Fuente, J. Song, J. Ni, C. Zhang, D. Cui,Nano-Micro Letters 2020, 12.
[4] J. Yang, C. Zhang, Wiley Interdisciplinary Reviews-Nanomedicine and Nanobiotechnology 2020, 12, e1612.
