铁纳米氧化物由于其良好的磁共振造影性能和生物相容性已被批准用于临床肿瘤诊断,但近期js345线路检测张春富课题组发现铁纳米氧化物在调节肿瘤微环境和肿瘤代谢、促进肿瘤治疗方面也扮演非常积极的角色,相关研究已于近期相继发表在领域重要期刊Advanced Functional Materials 和ACS Nano。
免疫检查点抑制疗法(ICB)是目前肿瘤免疫治疗的主导方法,对某些特定癌症疗效显著,但并不是对所有癌症普遍有效。越来越多的证据表明,ICB反应性与肿瘤免疫微环境(TIME)密切相关。特别地,对于缺乏肿瘤浸润性淋巴细胞(TIL)向肿瘤核心浸润的“非炎症”或“排除型”肿瘤,ICB疗法具有低响应性和不良预后。因此,促进肿瘤内TILs的积累对于提高目前ICB疗法的疗效至关重要。除了基于T细胞的免疫治疗之外,激活肿瘤相关巨噬细胞(TAMs)来攻击肿瘤细胞近年来也引起了广发的关注。TAMs长期以来被认为完全来源于骨髓来源的单核细胞前体,导致目前基于巨噬细胞的免疫治疗主要停留在调节TAMs的总群体。
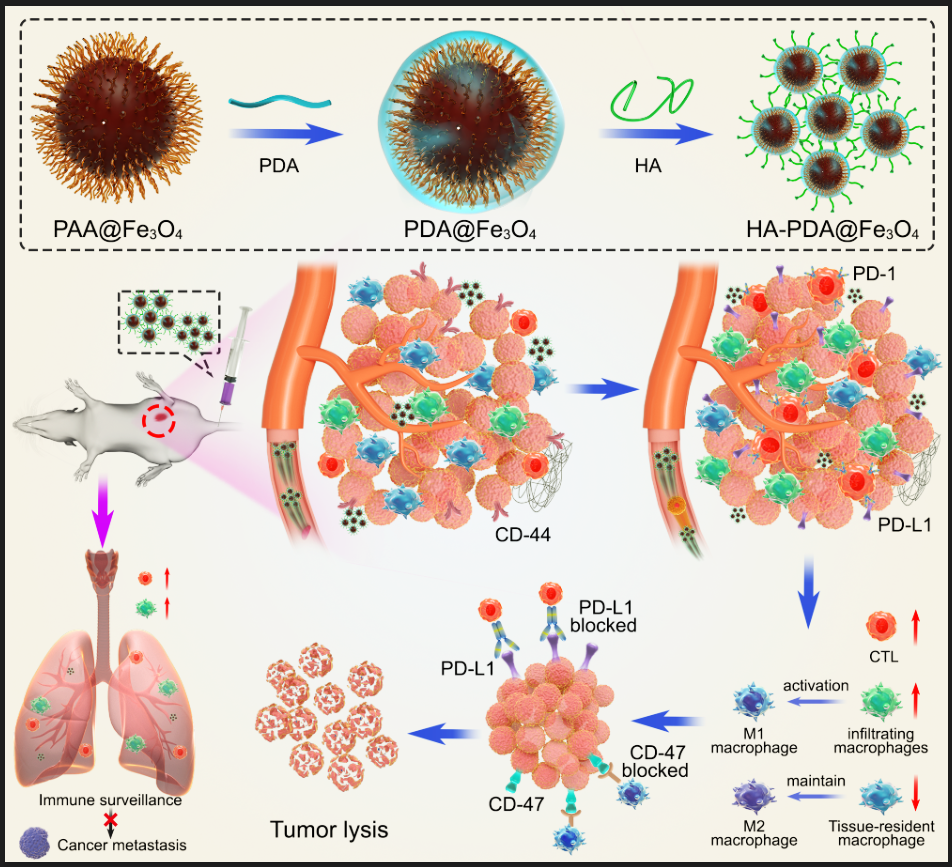
图1“免疫指针”HA-PDA@Fe3O4招募T细胞并优化巨噬细胞亚型和比例
然而,随着现代谱系追踪技术的发展,发现TAMs由两种亚型组成:来源于骨髓单核细胞的浸润性巨噬细胞和来源于卵黄囊和胎肝的组织驻留型巨噬细胞。而不同来源的TAMs在肿瘤进展中的作用因肿瘤的类型和发展阶段而有很大差异,并表现出多层次的激活。这为巨噬细胞疗法带来了挑战和机遇;然而,如何调节不同来源的TAMs亚型比例以增强癌症免疫治疗,以及TAMs亚型对激活剂的响应性是否不同仍不清楚。
近期js345线路检测张春富课题组提出通过透明质酸(HA)功能化磁性纳米颗粒,构建一种基于铁氧化物的磁性纳米 “免疫指针”。HA是一种细胞外基质成分,能够靶向各种CD44过表达的肿瘤,并介导多种免疫细胞的粘附和迁移。因此,透明质酸功能化的磁性纳米粒子(HA-PDA@Fe3O4)可以高效地在乳腺癌中积累并深入肿瘤实质。肿瘤内高浓度的透明质酸作为“路标”,可以直接招募淋巴细胞,并通过级联放大效应产生更多的趋化因子,将免疫“冷”肿瘤转化为“热”肿瘤。同时,HA-PDA@Fe3O4可以通过募集和激活浸润性巨噬细胞,同时减少维持M2表型的组织驻留巨噬细胞,有效地重塑肿瘤相关巨噬细胞的多样性、起源和活化。因此,HA-PDA@Fe3O4协同改善了基于T细胞和巨噬细胞的免疫疗法。更为重要的是,HA-PDA@Fe3O4还可以显著改善肺部免疫微环境,抑制乳腺癌肿瘤肺转移形成(图1,2)。
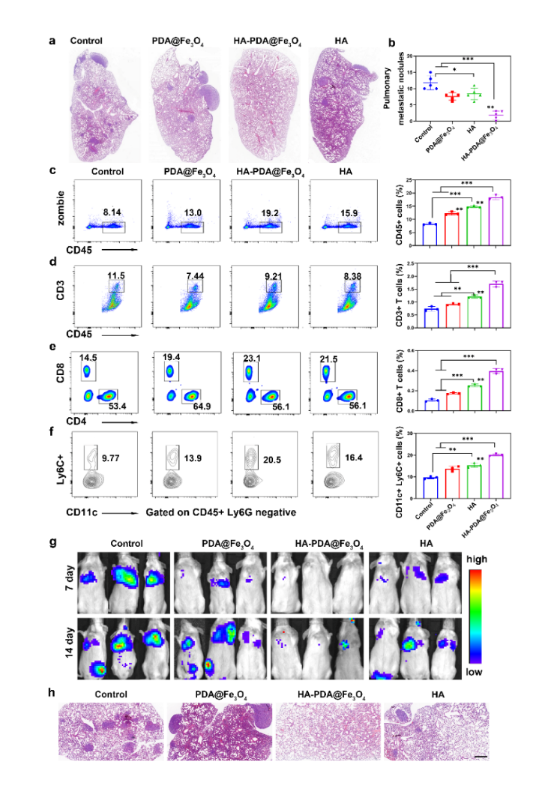
图2 改善肺部免疫微环境抑制乳腺癌转移
该研究成果近期在线发表于Advanced Functional Materials(https://doi.org/10.1002/adfm.202009116)。
同时,对于传统的放化疗,由于肿瘤对治疗耐受性导致治疗失败。该团队近期研究发现铁纳米氧化物颗粒温热应激(45℃)可损害前列腺癌C4-2细胞应对Fe3O4纳米颗粒所介导氧化应激下的抗氧化反应,并触发特定的脂质代谢重编程。这种代谢控制行为破坏了肿瘤的氧化还原稳态,并产生了过量的脂质过氧化物,从而引起肿瘤细胞铁死亡,促使其对传统治疗敏感。基于此发现,该团队进一步设计一种由靶向肽修饰、液态1H-全氟戊烷(1H-PFP)和Fe3O4纳米颗粒共包覆体系(GBP@Fe3O4),提出了一种光热触发肿瘤特异性铁死亡的新策略,并证明乙酰辅酶A合成酶ACSBG1是这一热诱导铁死亡策略中的关键调控因子,敲除该基因可实现肿瘤细胞死亡命运从铁死亡向非铁死亡模式的转换。相关研究近期发表也于近期在线发表于相关领域重要期刊ACS Nano (https://pubs.acs.org/doi/full/10.1021/acsnano.1c00380)。
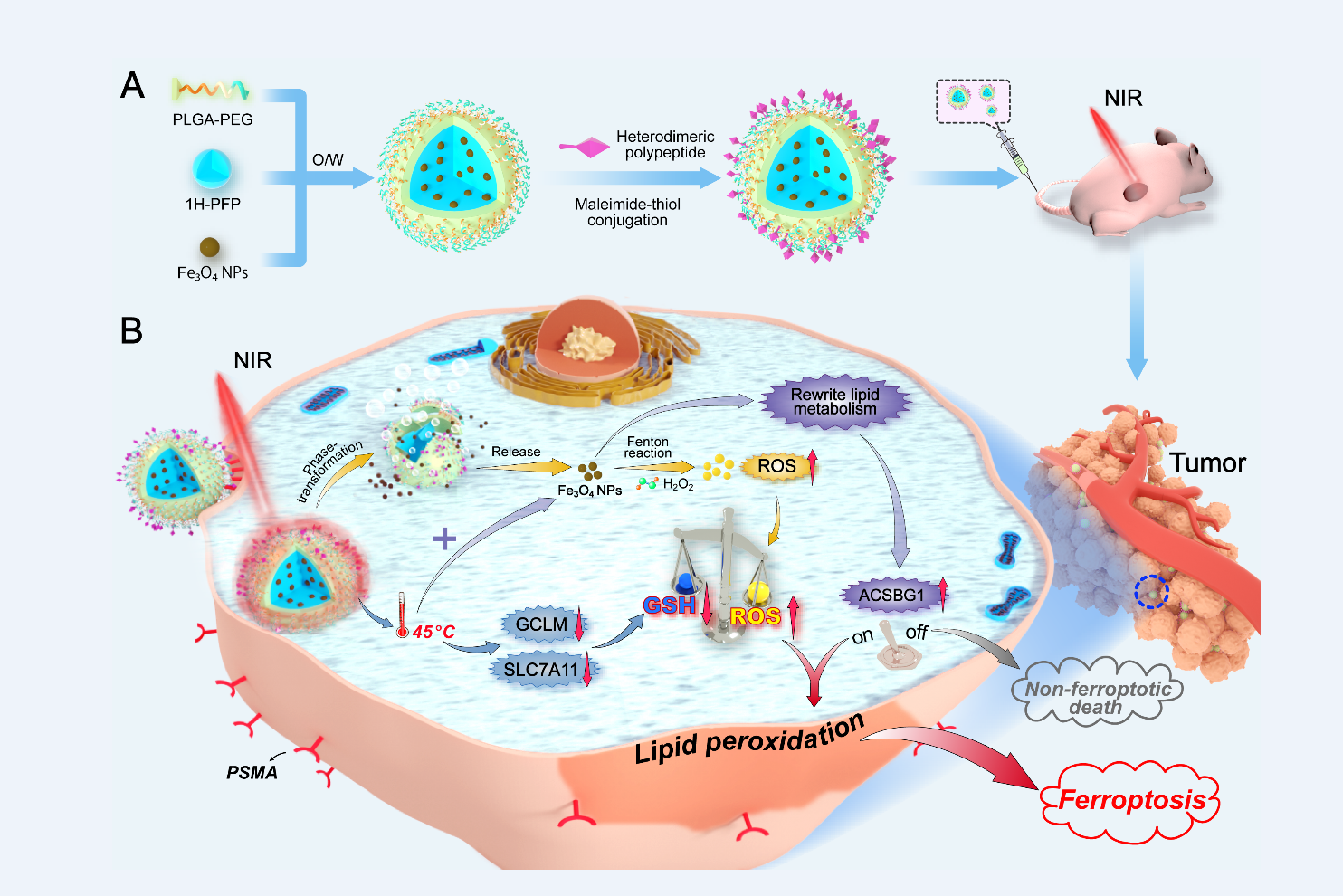
图3 GBP@Fe3O4合成及肿瘤代谢重编程诱导铁死亡治疗肿瘤机制的示意图
上述研究拓展了铁纳米氧化物磁性材料在肿瘤诊断和治疗方面的应用,对促进肿瘤新兴疗法和改善传统疗法具有有益的借鉴。
供稿单位:科研与学科办
撰稿人:张春富
